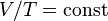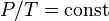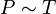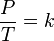|
 |
|
 |
| EN |
|
Поиск по сайту
Авторизация
Подписка на новости
|
Закон Шарля
Зако́н Ша́рля или второй закон Гей-Люссака — один из основных газовых законов, описывающий соотношение давления и температуры для идеального газа. Экспериментальным путем зависимость давления газа от температуры при постоянном объёме установлена в 1787 году Шарлем и уточнена Гей-Люссаком в 1802 году. Неоднозначность терминологииВ русско- и англоязычной научной литературе существуют некоторые различия в наименовании законов, связанных с именем Гей-Люссака. Эти различия представлены в следующей таблице.
Формулировка законаФормулировка закона Шарля следующая:
Проще говоря, если температура газа увеличивается, то и его давление тоже увеличивается, если при этом масса и объём газа остаются неизменными.Закон имеет особенно простой математический вид, если температура измеряется по абсолютной шкале, например, в градусах Кельвина. Математически закон записывают так: или где:
Этот закон справедлив, поскольку температура является мерой средней кинетической энергии вещества. Если кинетическая энергия газа увеличивается, его частицы сталкиваются со стенками сосуда быстрее, тем самым создавая более высокое давление. Для сравнения того же вещества при двух различных условиях, закон можно записать в виде: Закон Амонтона о давлении и температуре: закон давления, описанный выше, должен быть на самом деле приписан Гильому Амонтону, который в конце XVII века (точнее между 1700 и 1702 годом) обнаружил, что давление фиксированной массы газа, поддерживаемого при постоянном объёме, пропорционально его температуре. Амонтон обнаружил это при постройке «воздушного термометра». Называть это закон законом Гей-Люссака просто некорректно, поскольку Гей-Люссак исследовал взаимосвязь между объёмом и температурой, а не давлением и температурой. Закон Шарля был известен как закон Шарля и Гей-Люссака, поскольку Гей-Люссак опубликовал его в 1802 году с использованием по большей части неопубликованных с 1787 года данных Шарля. Закон Гей-Люссака, закон Шарля и закон Бойля — Мариотта все вместе образуют объединённый газовый закон. В сочетании с законом Авогадро эти три газовых закона обобщаются до уравнения состояния идеального газа. Источник: ru.wikipedia.org |
Читайте бесплатно
События из истории измерений
|